ESTEVIA: edulcorante acalórico en alza
 |
| Flores de Stevia rebaudiana Bertoni |
El jugo obtenido directamente de la planta es entre 15 y 30 veces mas dulce que la sacarosa, mientras que el extracto obtenido por cristalización es entre 250–300 veces más dulce. Los glucósidos de estevia no afectan la concentración de glucosa en sangre, por lo que resultan inocuos para los diabéticos y útiles en dietas hipocalóricas. Los glucósidos más concentrados son el esteviósido (5–10%), el rebaudiósido A (2–4%), el rebaudiósido C (1–2%) y el dulcósido A (0,5–1,0%).

Los extractos de Stevia rebaudiana bertoni y el esteviósido (glucósidos concentrados por cristalización) se han usado ampliamente como un edulcorante de bajas calorías en Japón, China, Corea del Sur y Taiwán. Este producto fue aprobado como suplemento alimentario en los Estados Unidos (Geuns, 2003) (1).
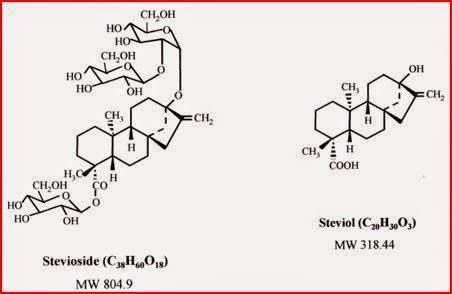
La microflora intestinal metaboliza los glicósidos de esteviol a una forma agliconada por sucesivos pasos de hidrólisis, que van separando las unidades de glucosa que integran su molécula. Este proceso parece ser similar en animales de experimentación y en humanos, siendo mas lenta la hidrólisis del alcaloide rebaudiosido A a esteviol que la del esteviosido. La absorción de esteviol es muy escasa. Se han observado pequeñas cantidades de esta sustancia en plasma en pacientes tratados oralmente con esteviosido, habiendo considerable variabilidad individual. La ruta de metabolozación del esteviol absorbido parece ser principalmente la glucoronización o sulfatación. También se ha observado la metabolización hepática del esteviol por una via dependiente del CYP (2).

Por otra parte, el metabolito agliconado, el steviol, mostró indicios a ser mutagénico y bactericida en cultivos de Salmonella typhimurium TM677 in vitro. Por lo tanto, el espectro de sus efectos biológicos y el potencial para las interacciones adversas con otros fármacos sigue siendo incierto, especialmente en relación con su uso crónico o en dosis elevadas. Las características estructurales mas importantes para la expresión de actividad mutagénica incluyen un grupo hidroxi en la posición 13 y un enlace insaturado que une los átomos de carbono en las posiciones 16 y 17. Se sugirió que algunos metabolitos del steviol, generados por el sistema enzimático S9 tiene una actividad genotóxica en bacterias y en cultivo de células de mamifero, por lo que se ponía en duda la seguridad de su consumo (3).
Sin embargo, en ensayos relevantes para riesgo en humanos, no se ha demostrado que ni el esteviósido, ni su metabolito esteviol aglicona reaccionen directamente con el ADN o produzcan daño genotóxico. La actividad mutagénica de esteviol y algunos de sus derivados, exhibida en la cepa TM677, no se reprodujo en las mismas bacterias que tienen los procesos normales de reparación del ADN. Los resultados del único estudio in vivo que detecto roturas en el ADN en tejidos de rata Wistar por esteviósido, no fueron confirmados en experimentos en ratones y parecen ser procesos distintos de la lesión directa del ADN estudiado. Ni el esteviósido ni el steviol indujeron efectos clastogénicos en dosis extremadamente altas in vivo. Los datos disponibles sobre toxicidad genética concluyen que estas sustancias no suponen un riesgo de daño genético para el consumo humano (4,5,6).
Aunque el glicosido esteviósido fue negativo en todos los ensayos, el metabolito esteviol agliconado dio lugar a un aumento en mutaciones en S. typhimurium TM677, en aberraciones cromosómicas y en mutaciones de genes en células CHL (Chinese hamster lung fibroblast cell line) en presencia de la mezcla enzimática S9. Aunque el número de células micronucleadas, en eritrocitos de la médula ósea, no aumentaron en ratones tratados con esteviol, los resultados del ensayo in vitro sugieren la necesidad de otros ensayos de mutagenicidad in vivo, para la evaluación más precisa de riesgo genotóxico del esteviol para humanos (7).
El esteviósido parece tener poca o ninguna toxicidad aguda (7). Del mismo modo, se cree que el consumo crónico de esteviósido plantea poco riesgo humano (8). Este estudio mostró que el consumo oral de esteviósido, en cantidades de hasta 550 mg/Kg/día (es decir, más de 200 veces la ingesta máxima probable en el hombre estimada en alrededor de 2 mg/Kg/día) durante 2 años, no tuvo efectos tóxicos o cancerígenos en ratas (9).
Por otra parte, el estudio de los mecanismos de transporte renal y excreción de esteviosidos y sus metabolitos llegó a la conclusión de que el esteviósido no se transporta por los transportadores de aniones orgánicos basolaterales. Esteviol tiene una alta afinidad tanto para TAOh 1 como para hOAT3 y, por lo tanto, tiene un potencial significativo para disminuir el aclaramiento renal de los fármacos aniónicos y sus metabolitos (10). Ello plantea algunas dudas sobre su interacción con otros tratamientos que pueda estar siguiendo el paciente.
La exhaustiva revisión realizada por el Expert Committee on Food Additives (JECFA) de la FAO/WHO concluye señalando que el esteviosido y rebaudosido A no son genotóxicos tanto in vitro como in vivo. Y que la genotoxicidad del esteviol y de algunos de sus derivados oxidativos expresada in vitro no se ha manifestado in vivo. El nivel de dosis de esteviosidos, no asociados a efectos tóxicos, se ha marcado en 970 mg/kg/día. Fijándose la dosis aceptable diaria (temporary acceptable daily intake) en 0 a 2 mg por kg de peso corporal y día, para los glicósidos de esteviol, expresados como esteviol, en relación con la dosis de no observación de efectos de los esteviosidos (970 mg/kg/dia) y de esteviol (383 mg/kg/día. . En cualquier caso, se ha señalado que son necesarios nuevos datos sobre los efectos farmacológicos de esteviosidos en humanos (2).
BIBLIOGRAFÍA:
- Geuns JM. Stevioside. Phytochemistry. 2003 Nov;64(5):913-21
- D. J. Benford, M. DiNovi, J. Schlatter. Steviol glycosides. Safety evaluation of certain food additives. Prepared by the Sixty-third meeting of the Joint FAO/WHO. Expert Committee on Food Additives (JECFA). World Health Organization, Geneva, 2006. 54:117.
- Pezzuto JM, Compadre CM, Swanson SM, Nanayakkara D, Kinghorn AD. Metabolically activated steviol, the aglycone of stevioside, is mutagenic. Proc Natl Acad Sci U S A. 1985 Apr;82(8):2478-82.
- Brusick DJ. A critical review of the genetic toxicity of steviol and steviol glycosides. Food Chem Toxicol. 2008 Jul;46 Suppl 7:S83-91
- Urban JD, Carakostas MC, Brusick DJ. Steviol glycoside safety: is the genotoxicity database sufficient? Food Chem Toxicol. 2013 Jan;51:386-90.
- Suttajit M, Vinitketkaumnuen U, Meevatee U, Buddhasukh D. Mutagenicity and human chromosomal effect of stevioside, a sweetener from Stevia rebaudiana Bertoni. Environ Health Perspect. 1993 Oct;101 Suppl 3:53-6.
- Matsui M1, Matsui K, Kawasaki Y, Oda Y, Noguchi T, Kitagawa Y, Sawada M, Hayashi M, Nohmi T, Yoshihira K, Ishidate M Jr, Sofuni T. Evaluation of the genotoxicity of stevioside and steviol using six in vitro and one in vivo mutagenicity assays. Mutagenesis. 1996 Nov;11(6):573-9
- Yamada A, Ohgaki S, Noda T, and Shimiqu M (1985) Chronic toxicity study of dietary stevia extracts in F344 rats. J Food Hyg Soc Japan 26: 183–196.
- Xili, L., Chengjiany, B., Eryi, X., Reiming, S., Yuengming, W., Haodong S., Zhiyian, H., 1992. Chronic oral Toxicity and Carcinogenicity Study of Stevioside in Rats. Food Chem. Toxicol. 30, 957-965.
- Chutima Srimaroeng, Varanuj Chatsudthipong, Amy G. Aslamkhan, John B. Pritchard. Transport of the Natural Sweetener Stevioside and Its Aglycone Steviol by Human Organic Anion Transporter (hOAT1; SLC22A6) and hOAT3 (SLC22A8). JPET May 2005; 313(2):621-628.
No hay comentarios:
Publicar un comentario